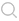目前,阴极保护原理在当代的应用可谓是越来越广泛,阴极保护原理是值得我们好好学习的,现在我们就深入了解阴极保护原理。

阴极保护原理
对被保护金属施加负电流,通过阴极极化使其电极电位负移至金属的平稳电位,从而抑阻金属腐蚀的保护方法称为阴极保护。
在金属表面上的阳极反应和阴极反应都有自己的平衡点,为了达到完全的阴极保护,必须使整个金属的电位降低到最活泼点的平衡电位。设金属表面阳极电位和阴极电位分别为Ea和Ec,金属腐蚀过程由于极化作用,阳极和阴极的电位都接近于交点S所对应的电位Ecorr(自然腐蚀电位),这时的腐蚀电流为Icorr。
如果进行阴极极化,电位将从向更负的方向移动,阳极反应曲线EcS从S向C 点方向延长,当电位极化到E1时,所需的极化电流为I1,相当于AC线段,其中BC线段这部分是外加的,AB线段这部分电流是阳极反应所提供的电流,此时金属尚未腐蚀。如果使金属阴极极化到更负的电位,例如达到Ea,这时由于金属表面各个区域的电位都等于Ea,腐蚀电流为零,金属达到了完全保护,此时外加电流Iapp1即为完全保护所需电流。
根据提供阴极极化电流的方式不同,阴极保护又分为牺牲阳极阴极保护法和外加电流阴极保护法两种。
阴极保护是一种控制金属电化学腐蚀的保护方法。在阴极保护系统构成的电池中,氧化反应集中发生在阳极上,从而抑阻了作为阴极的被保护金属上的腐 蚀。阴极保护是一种基于电化学腐蚀原理而发展的一种电化学保护技术。可从电极反应、极化曲线和极化图以及电位-pH图等诸方面理解阴极保
任意两种金属/合金的组合,都可构成电化学电池;低电位者为电池的阳极,主要发生氧化反应;高电位者为阴极,主要发生还原反应。由于阳极和阴极 之间存在着电位差,外部电连接的阳极和阴极之间将有电流流过电池,从而加速了阳极的腐蚀,同时抑阻阴极的腐蚀,使阴极金属获得阴极保

阴极保护原理
根据混合电位理论,金属表面上局部阳极和局部阴极通过各自的极化而汇聚至一个共同的混合电位,即金属的自腐蚀电位Ecorr;此时局部阳极的氧化反应速度与局部阴极的还原反应速度相等,即等于金属的自腐蚀电流icorr,如图1所示。图中给出了铁在中性水溶液中的局部阳极的真实极化曲线(Ee,aFPSA’)和局部阴极的真实极化曲线(Ee,cSMBD), 以及该体系的实验的阳极极化曲线(EcorrA)和阴极极化曲线(EcorrGOBB’)。
阴极极化至任一电位时的外加负电流都等于此时极化后的局部阴极还原反应电流ic与局部阳极氧化反应电流ia之差。当阴极极化使金属电极电位负移 至局部阳极反应的平稳电位Ee,a时,外加极化电流几乎就等于局部阴极电流,因为此时的局 部阳极电流已可予以忽略不计,当然此时铁上腐蚀也就被完全抑阻了,即获得了完全阴极保护。
|
|
|
图2 电位-pH图上的阴极保护范围(Fe-H2O系) |
电位-pH图是从热力学说明阴极保护的理论基础。图2是根据热力学计算获得的Fe-H2O系电位-pH图。可以看 出,在pH=6~7的中性水中,铁呈活化腐蚀状态;通过外加负电流的阴极极化,可使铁的电 极电位从腐蚀区进入免蚀区。对铁,这是一个热力学稳定区,金属腐蚀停止,即此时铁获得了阴极保护。
图3给出了铁在 NaCl水溶液(或土壤)中于金属界面处发生的电化学腐蚀反应过程,以及阴极保护系统通过镁阳极或外电源产生的外加负电流对这些反应过程的作用影响,说明 了各种反应质点和反应产物的存在和传递。由于阴极保护系统通过牺牲阳极或外电源,能对金属提供足够量的电子(施加所需的负电流),使金属界面呈负电性和达 到足够负的电极电位,从而抑阻氧化反应(Fe→Fe2++2e); 此时还原反应所需电子完全从牺牲阳极或外电源获得。由此实现了阴极保护,停止了金属的腐蚀过程。
综上所述,本文已为讲解阴极保护原理,相信大家对阴极保护原理的认识越来越深入,希望本文能对各位读者有比较大的参考价值
浏览过本文<阴极保护原理>的人也浏览了
阴极保护电源的设计
http://www.cntronics.com/cp-art/80007169
阴极保护及阴极保护技术问答
http://baike.cntronics.com/abc/988
透射电镜原理
http://baike.cntronics.com/abc/3633