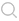分析法,我们在日常生活、工作中都经常用到,但不知道大家对“电导分析法”是否知道呢?本文收集整理了一些资料,希望本文能对各位读者有比较大的参考价值。

电导分析法
电导分析法英文名称:method of conductometric analysis定义:一种通过测量溶液的电导率确定被测物质浓度,或直接用溶液电导值表示测量结果的分析方法。应用学科:机械工程(一级学科);分析仪器(二级学科);电化学式分析仪器-电化学式分析仪器分析原理(三级学科)。
简介
利用测量电导或电导的变化进行分析的电化学分析法。
电导滴定法测量滴定过程中电导G的变化,然后根据滴定曲线(有时以直线形式出现)求出滴定终点,从而算出欲测物质的量。电导滴定法可分中和滴定、沉淀滴定、络合滴定和氧化还原滴定。
图1为滴定曲线,分三种类型。
图1a是中和滴定的滴定曲线(见酸碱滴定法),其中曲线1是强碱滴定弱酸的滴定曲线,滴定终点很明显,因为在反应中生成水,所以电导不断降低,直到终点时不再下降,过量的碱又使电导很快地上升;曲线2是弱碱滴定强酸,过了终点以后,由于弱碱的电离度很小,虽然加入过量的弱碱,电导几乎不变。
图1b中的曲线1是沉淀滴定的滴定曲线(见沉淀滴定法),例如在AgNO3+NaCl─→AgCl+NaNO3反应中,Na+代替Ag+,生成氯化银沉淀,所以滴定开始时电导变化不大,过了终点以后,继续加入氯化钠,电导上升;曲线2是络合滴定的滴定曲线(见络合滴定法),例如在酸性溶液中进行以下反应;Hg(NO3)2+2KCN─→Hg(CN)2+2KNO3,两个K+代替Hg2+,生成Hg(CN)2,滴定开始时,电导变化不大,过了终点以后,继续加入KCN,发生H++CN-+K+─→HCN+K+反应,由于HCN的电离度很小,因此电导下降。
图1c是强碱滴定极弱的酸的滴定曲线,电导逐渐增大,过了终点以后,因加入强碱而使电导上升,终点在两直线的转折点。
实际上,在终点附近的滴定曲线往往呈圆弧形或终点很不明显。这一现象与酸碱的强弱、沉淀的溶解度、络合物的稳定性和欲测物质的浓度有关,太稀的溶液(浓度在10-3Μ以下)不容易得到准确的滴定结果。电导滴定法也可用于非水介质中。
电导测量法测量电导的电导池有不同的设计方案,一般由两个铂黑电极(面积为1厘米2)组成。
测量电导实际上是测量电阻,图2是最常用的惠斯通电桥法的线路图。Rs是欲测的电阻(即欲测的电导),R1大致等于Rs,C为可变电容。调节R2和R3,使电桥两端a和b的电位差等于零,由“指零”(G)来指示,它是一个耳机或交流检流计,当电桥平衡时:
读出R1、R2和R3便可得出Rs。
根据以上原理设计的各种电导仪可用于测定弱酸的离解常数、沉淀的溶度积以及检测水的纯度。实验室中高纯的电导水的电导率小于0.1×10-6西(门子)/厘米,蒸馏水与空气中的二氧化碳达到平衡时平衡水的电导率约为1×10-6西/厘米,一般电导滴定的溶液的电导率大于1×10-3西/厘米,所以水的电导率可以忽略不计。

电导分析法
综上所述,本文已为讲解电导分析法,相信大家对电导分析法的认识越来越深入,希望本文能对各位读者有比较大的参考价值。
浏览过本文<电导分析法是什么?>的人也浏览了
电导率测定仪
http://baike.cntronics.com/abc/4831
电导的单位
http://baike.cntronics.com/abc/2185
什么是电导变送器?
http://baike.cntronics.com/abc/5350